Química 2
Escuela de Química
Facultad de Ciencias
Universidad Industrial de Santander
Módulo 2. Estequiometría molar, reacciones Redox y termoquímica.
Lección 2.2 Reacciones Redox.
Volver al módulo

1. Preparación de la lección
Competencias de la lección
- Comprender la diferencia entre ecuaciones moleculares, iónicas e iónicas netas y su aplicación en reacciones redox.
- Aprender a balancear ecuaciones redox utilizando el método del estado de oxidación y el método del ion-electrón.
- Realizar cálculos estequiométricos en reacciones redox para predecir cantidades de reactivos y productos.
- Identificar y clasificar los diferentes tipos de reacciones redox en procesos electroquímicos y electrolíticos.
- Aplicar los principios de la estequiometría y el balance redox para resolver problemas relacionados con reacciones químicas en medios acuosos.
Videos de Introducción
Catálogo de Simuladores
Catálogo de Libros
2. Profundización de la lección
Lección 2.2 Reacciones Redox.
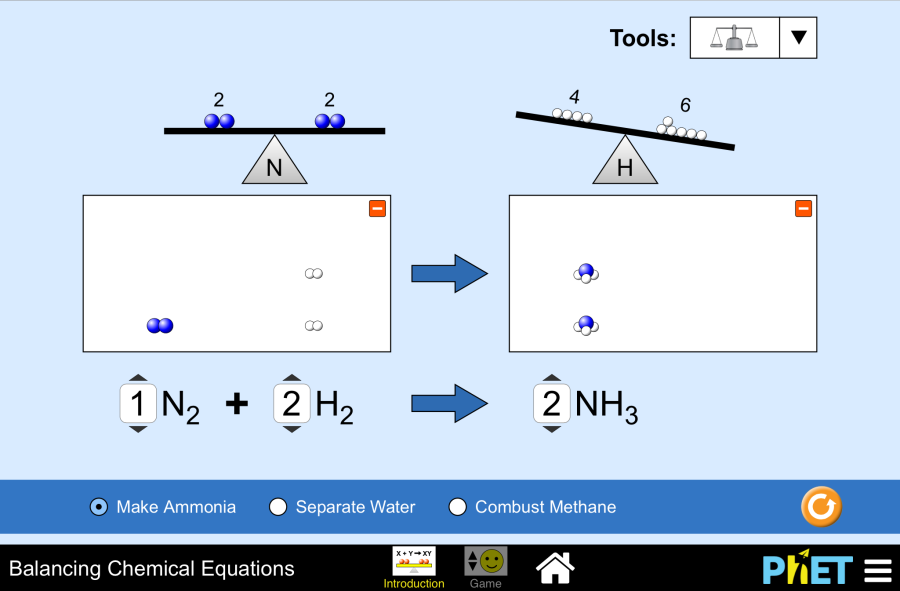
- Ecuaciones moleculares. (Bibliografía: Chang p.123, Brown p.122).
- Ecuaciones iónicas totales. (Bibliografía: Chang p.123, Brown p.122, Whitten p.216, Rosenberg p.194).
- Ecuaciones iónicas netas. (Bibliografía: Chang p.123, Brown p.122, Whitten p.216, Rosenberg p.194).
- Método del estado de oxidación (para ecuaciones moleculares). (Bibliografía: Por definir).
- Método del ion-electrón (para ecuaciones iónicas). (Bibliografía: Whitten p.216, Rosenberg p.184).
- Tipos de reacciones redox. (Bibliografía: Chang p.137, Brown p.131, Whitten p.222, Rosenberg p.182).
- Cálculos estequiométricos en procesos redox. (Bibliografía: Chang p.813, Brown p.830, Whitten p.223, Rosenberg p.185).
- Procesos electroquímicos y electrolíticos. (Bibliografía: Brown p.804, Rosenberg p.96).
(T13.2) Ecuaciones moleculares, iónicas e iónicas netas
(T13.3) Tipos de reacciones redox
3. Reto de la lección
Resumen
4. Cierre de la lección
Autoevaluación
¿Cuál es la diferencia entre una ecuación molecular y una ecuación iónica total?
¿Qué define a una reacción redox en términos de cambio de oxidación?
¿En qué se diferencia el método del estado de oxidación del método del ion-electrón para balancear ecuaciones redox?
¿Qué papel juega la estequiometría en el balance de ecuaciones redox?
¿Cómo se diferencian los procesos electroquímicos de los electrolíticos en términos de reacciones redox?