Química 2
Escuela de Química
Facultad de Ciencias
Universidad Industrial de Santander
Módulo 3. Cinética química y equilibrio químico.
Lección 3.2 Equilibrio químico.
Volver al módulo

1. Preparación de la lección
Competencias de la lección
- Comprender el concepto de reacciones reversibles e irreversibles y su relación con el equilibrio químico.
- Identificar y diferenciar entre equilibrios homogéneos y heterogéneos en sistemas químicos.
- Analizar el significado de la constante de equilibrio en términos de concentraciones, presiones parciales y fracciones molares.
- Calcular el cociente de reacción y relacionarlo con la constante de equilibrio para predecir la dirección de una reacción.
- Interpretar el valor de la constante de equilibrio para determinar si una reacción favorece los productos o los reactivos en condiciones de equilibrio.
Videos de Introducción
Catálogo de Videos
Catálogo de Simuladores
Catálogo de Libros
2. Profundización de la lección
Lección 3.2 Equilibrio químico.
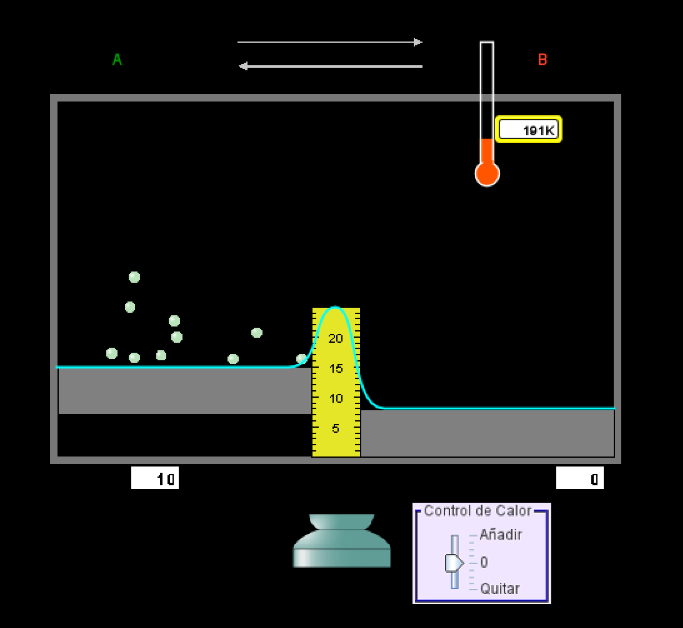
- Concepto de reacciones irreversibles y reversibles. (Bibliografía: Whitten p.668 ).
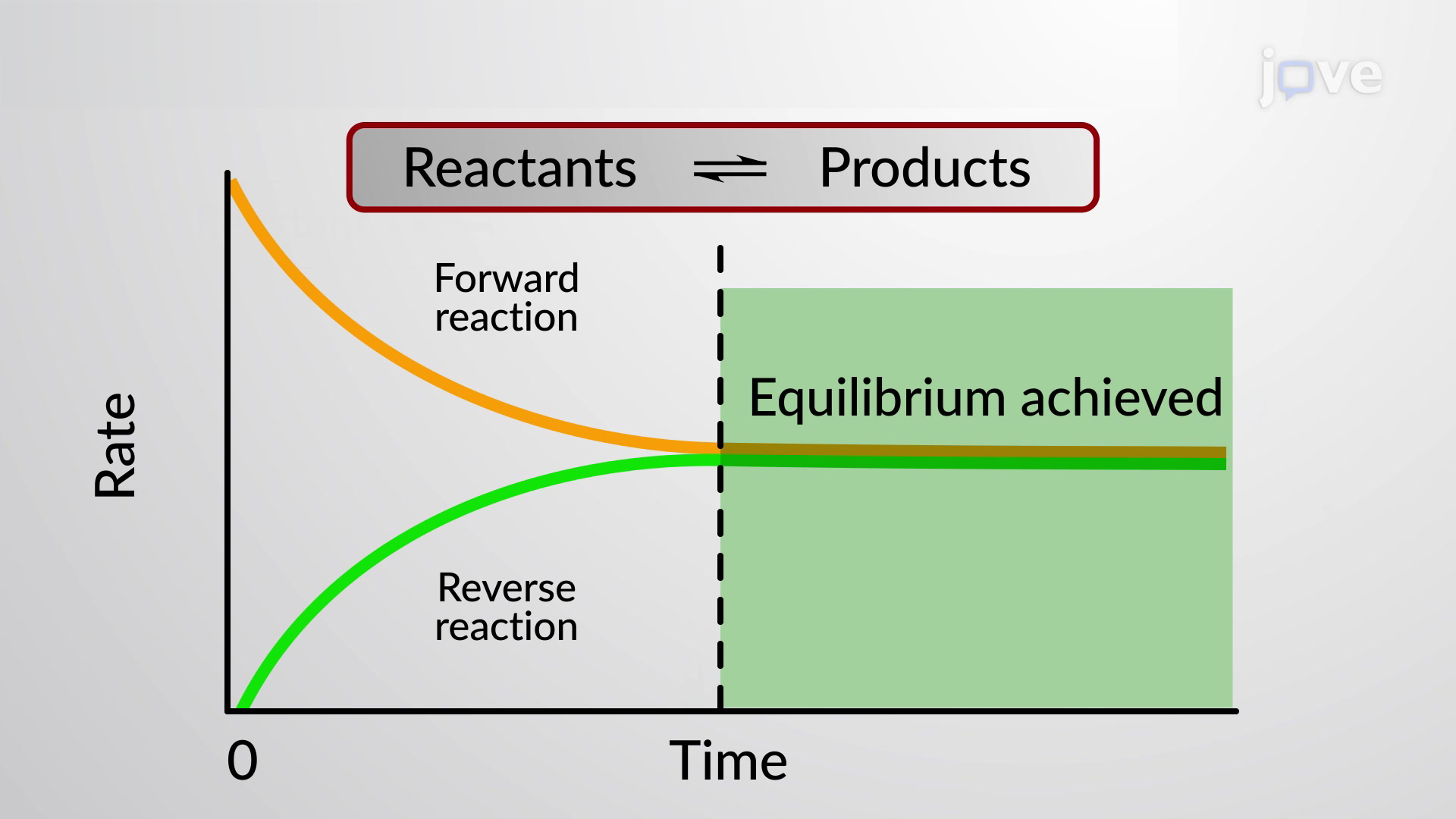
- Concepto de equilibrio. (Bibliografía: Brown p.612 , Whitten p.668 , Rosenberg p.253 ).
- Tipos de equilibrios: homogéneos y heterogéneos. (Bibliografía: Brown p.623 , Whitten p.700 ).
- Constante de equilibrio en función de concentraciones, presiones parciales y fracciones molares. (Bibliografía: Brown p.617 , Whitten p.670 , Rosenberg p.258 ).
- Cociente de reacción. (Bibliografía: Brown p.627 , Whitten p.691 , Rosenberg p.257 ).
- Significado de la constante de equilibrio. (Bibliografía: Brown p.614 , Whitten p.670 , Rosenberg p.258 ).
(T15.1) Reacciones y equilibrio
3. Reto de la lección
Resumen
4. Cierre de la lección
Autoevaluación
¿Qué diferencia existe entre una reacción reversible y una irreversible?
¿Cómo se define el equilibrio químico en una reacción?
¿En qué se diferencian los equilibrios homogéneos de los heterogéneos?
¿Cómo se expresa la constante de equilibrio en función de las concentraciones y las presiones parciales?
¿Qué indica el valor de la constante de equilibrio sobre la tendencia de una reacción en condiciones de equilibrio?