Química Básica
Escuela de Química
Facultad de Ciencias
Universidad Industrial de Santander
Módulo 3. Enlace químico, soluciones y estequiometría.
Lección 3.1 Enlace químico.
Volver al módulo

1. Preparación de la lección
Competencias de la lección
- Aplicar los símbolos de puntos de Lewis y la regla del octeto en la representación de enlaces: Usar los símbolos de puntos de Lewis para representar electrones de valencia y comprender cómo la regla del octeto influye en la estabilidad de las moléculas.
- Diferenciar entre enlace iónico y covalente y su nomenclatura: Comprender las características y formación de enlaces iónicos y covalentes, y nombrar correctamente compuestos iónicos (sales, óxidos, hidróxidos e hidruros metálicos) y covalentes, según sus fórmulas y proporciones.
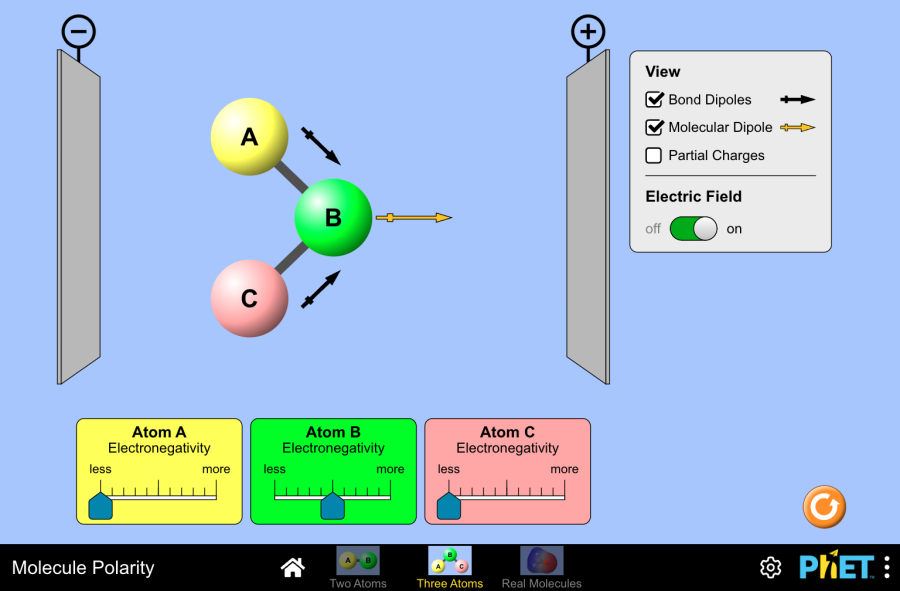
- Entender la polaridad de los enlaces y el concepto de electronegatividad: Explicar cómo la electronegatividad determina la polaridad en enlaces covalentes y distinguir los enlaces iónicos de los covalentes basándose en las diferencias de electronegatividad.
- Representar estructuras de Lewis y estructuras resonantes, considerando la carga formal: Dibujar estructuras de Lewis y estructuras resonantes para moléculas y calcular la carga formal para verificar la estructura más estable.
- Reconocer excepciones a la regla del octeto y comprender el enlace metálico: Identificar casos de octeto incompleto y comprender la naturaleza del enlace metálico, así como sus implicaciones en las propiedades físicas de los metales.
Catálogo de Videos
Catálogo de Simuladores
Catálogo de Libros
2. Profundización de la lección
- (T7.1) Símbolos de puntos de Lewis y la regla del octeto (Bibliografía: Chang p.369, Brown p.290, Whitten p.269, Rosenberg p.131)
- (T7.2) Enlace Iónico: Enlace Iónico; Nomenclatura de compuestos iónicos: sales, óxidos e hidróxidos; Hidruros metálicos (Bibliografía: Chang p.370, Brown p.291, Whitten p.251, Rosenberg p.129)
- (T7.3) Enlace covalente: Enlace covalente y nomenclatura de compuestos covalentes; Fórmulas y proporciones de combinación (Bibliografía: Chang p.377, Brown p.296, Whitten p.258, Rosenberg p.132)
- (T7.4) Electronegatividad: Polaridad del enlace covalente y Electronegatividad; Cómo distinguir los enlaces iónicos de los covalentes (Bibliografía: Chang p.380, Brown p.298, Whitten p.276, Rosenberg p.133)
- (T7.5) Representación de las estructuras de Lewis y estructuras resonantes: Carga formal (Bibliografía: Chang p.387, Brown p.307, Whitten p.267, Rosenberg p.132)
- (T7.6) Excepciones a la regla del octeto: Octeto incompleto (Bibliografía: Chang p.392, Brown p.360, Whitten p.269)
- (T7.8) Enlace metálico (Bibliografía: Brown p.476, Rosenberg p.144)
- (T7.9) Nomenclatura de compuestos iónicos y moleculares (Bibliografía: Brown p.59, Whitten p.49, Rosenberg p.129)
Lección 3.1 Enlace químico.
3. Reto de la lección
Resumen
4. Cierre de la lección
Autoevaluación
¿Qué son los símbolos de puntos de Lewis y cómo se utilizan para representar los enlaces en compuestos
siguiendo la regla del octeto?
¿Cuáles son las principales características de los enlaces iónicos y cómo se nombran los compuestos
iónicos como sales, óxidos e hidróxidos?
¿En qué se diferencian los enlaces covalentes de los iónicos, y cómo se determina la polaridad de un
enlace covalente en función de la electronegatividad?
¿Qué son las estructuras de resonancia y la carga formal, y cómo se representan en las estructuras de
Lewis?
¿Cuáles son las excepciones a la regla del octeto y en qué tipo de compuestos o elementos suelen
ocurrir?